内容推送|用于增强抗肿瘤疫苗的具有光热模式的真核-原核复合纳米平台
2020年,浙江大学化学学院汤谷平教授以及白宏震教授课题组在《Advanced Materials》发表了题为“A Hybrid Eukaryotic–Prokaryotic Nanoplatform with Photothermal Modality for Enhanced Antitumor Vaccination”的研究论文。
DOI: 10.1002/adma.201908185
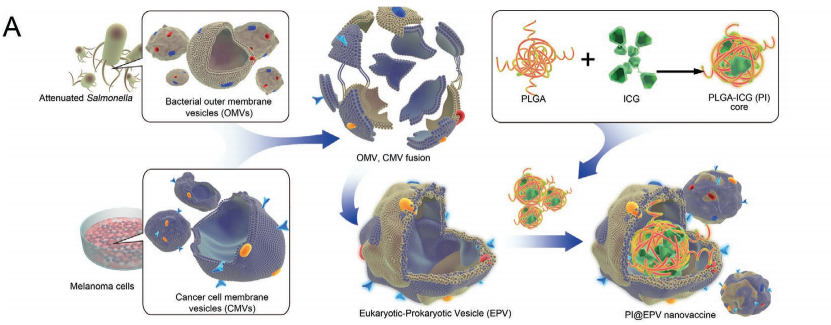
该文中,构建了黑色素瘤细胞膜囊泡(CMVs)和沙门氏菌外膜囊泡(OMVs)的真核-原核纳米(EPV)平台。融合的EPV将肿瘤特异性抗原与天然佐剂整合,表现出刺激免疫和唤起肿瘤特异性免疫反应的能力。疫苗接种表明,EPV系统可以保护小鼠免受黑色素瘤的侵染。表现出作为癌症疫苗的潜力。EPV平台具有较高的可扩展性可加载互补的光热模式,将ICG的PTT(PI)与免疫治疗相结合。局部消除与持久抑制相结合的抗肿瘤协同作用已被证实,PI@EPV也被证实为一种增强的治疗性疫苗。
该研究揭示了通过真核-原核融合技术实现的一种新的生物相容性和可扩展的疫苗平台,提供了一种新的仿生策略,并为增强组合抗肿瘤疫苗接种提供了一种简便的方法。
1)EPV构建
融合EPV的构建是将与携带抗原的黑色素瘤细胞膜外膜囊泡(CMVs)和天然佐剂沙门氏菌外膜囊泡(OMVs)进行整合。
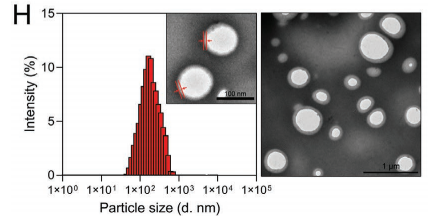
经研究发现在CMVs:OMVs=2:1时,EPV整体融合度较好,测定此时EPV粒径约100nm。

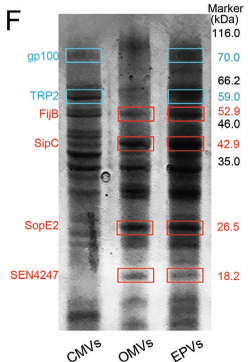
对EPV进行SDS-PAGE及WB,EPV具有黑色素瘤膜相关特异性抗原及天然佐剂相关生物标志物。表明EPV集成了CMV和OMV相关优势。
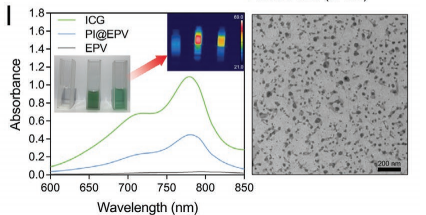
将PI(PLGA-ICG)作为纳米内核嵌入到EPV形成PI@EPV测定粒子大小约300nm,并将PI@EPV检测发现此颗粒可吸收近红外光,并具有将其转化为对癌细胞产生的细胞毒性热量的能力。
2)PI@EPV有效诱导肿瘤特异性免疫
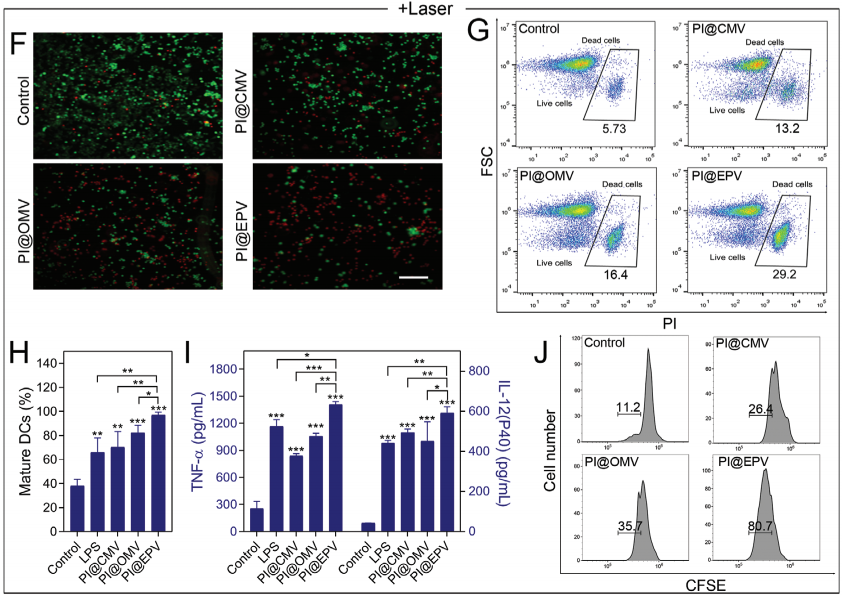
在无NIR照射,PI@OMV和PI@EPV诱导BMDC成熟能力高于PI@CMV表明佐剂表达MAMP刺激DC成熟;PI@EPV对细胞因子激活高于PI@OMV,PI@CMV。可推断PI@EPV激活DC高于PI@OMV,PI@CMV。
PI@EPV处理的T细胞增殖显著增加。表明PI@EPV具有DC-T免疫激活功能。

黑色素瘤暴露在射线5min,与控制组相比,PI@NPs都具有致死率,其中PI@EPV致死率最高。PI@EPV使BMDC增多,诱导DC成熟。对比可看出TNF-α和IL-12细胞因子在辐射下PI@EPV比无辐射,分泌增多表明:光热介导免疫原性细胞死亡,会促进BMDC成熟。并且PI@EPV的免疫激活高于PI@NPs。
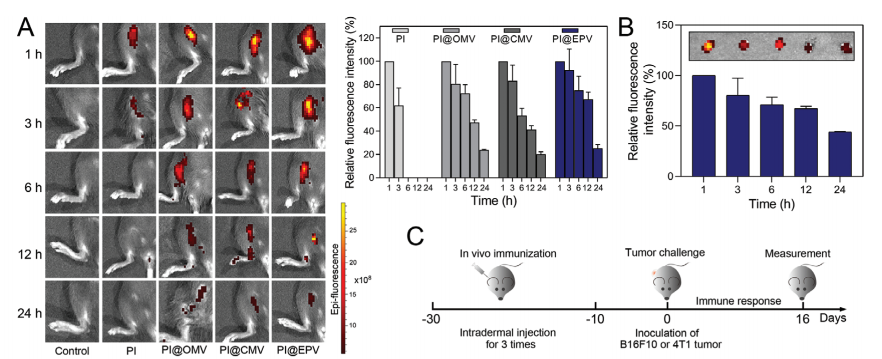
PI@EPV注射入小鼠C57体内,持续观察24h,ICG信号变化,随时间增加荧光信号衰减。体外荧光信号表明PI@EPV在24h具有较好的累积效应。PI@EPV能诱导DC成熟,进一步体内诱导免疫反应。体内预防性实验:使用B16F10和4T1细胞,小鼠分别注射(PI,PI@CMV, PI@OMV, and PI@EPV)后感染B16F10和4T1。
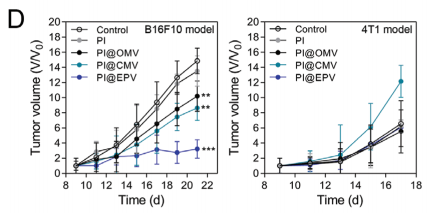
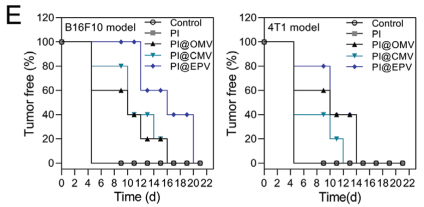
在B16F10模型中PI,PI@CMV, PI@OMV, 肿瘤抑制作用缓慢。而PI@EPV疫苗接种可有效抑制肿瘤发生,抑制率达到78.57%。与PI@CMV和PI@OMV组(15 d)相比,PI@ EPV接种延长了B16F10模型的无瘤时间(接种后19d),表明PI@ EPV具有持久的预防肿瘤能力。
与其他组相比,PI@EPV疫苗显示记忆T细胞(CD3+CD8+CD44+CD62L−)的诱导增强,这揭示了PI@EPV介导的有效预防肿瘤的机制。与其他组相比,PI@EPV疫苗接种上调CD107a的数量。接种不同配方疫苗后,血清中IFN-γ的表达变化可忽略不计,表明对系统免疫应答的影响较小。
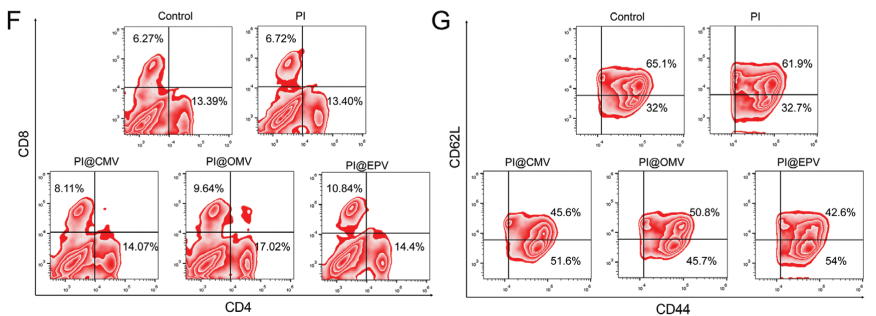

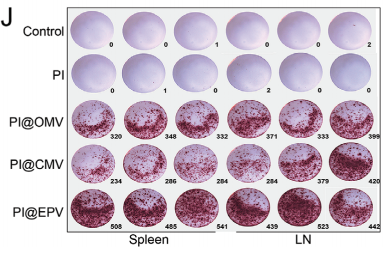
对于脾脏和淋巴结,ELISPOT显示接种后IFN-γ的表达水平显著上调。特别是,与PI@OMV和PI@CMV组相比,PI@EPV治疗诱导的IFN-γ表达最高,提示可有效诱导肿瘤特异性免疫。
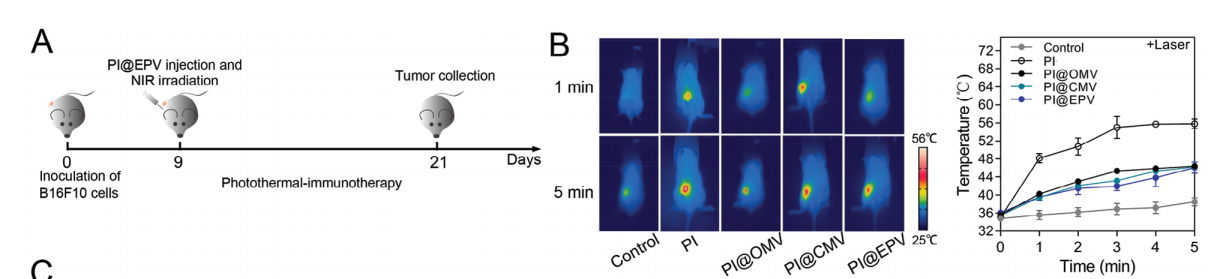
3)验证PI@EPV的体内光热免疫治疗性能
C57BL/6小鼠感染B16F10肿瘤,当肿瘤体积达到70-100mm3时,用纳米配方(PI、PI@CMV、PI@OMV和PI@EPV)进行单一治疗。与其他组相比,PI@EPV+激光治疗具有最强的肿瘤抑制效果,并且80%的治疗小鼠成为无肿瘤的小鼠。

由于光热具有强大的肿瘤消融作用,对癌细胞凋亡的诱导作用增强,肿瘤部位的肿瘤抗原增加,这增强了囊泡伪装制剂引发的抗肿瘤免疫反应。PI@EPV治疗显示肿瘤特异性CTL的浸润水平最高(19%),突出了佐剂OMV和肿瘤抗原CMV的整合是一种很有前途的肿瘤特异性免疫策略。特别是PI@EPV(+激光)组中gp100-四聚体+CD8+CTL的渗透率分别是PI@OMV(+激光)和PI@CMV(+激光)组的2.75倍和2.0倍,证实了具有ICG部分的混合真核-原核纳米平台能够实现协同光热治疗和免疫治疗。

本文将真核-原核融合,为肿瘤免疫原性、天然佐剂和可扩展疫苗平台的设计提供了新的前景。
免责声明:本篇内容无法鉴别所上传图片、字体或文字内容的版权,如无意中侵犯了哪个权利人的知识产权,请来信或来电告之,本微信公众号将立即予以删除,谢谢


